Enteropeptidáza je enzym duodenální sliznice, jehož funkcí je aktivace pankreatických enzymů. Stojí na začátku celé aktivační kaskády trávicích enzymů. Porucha enteropeptidázy vede k maldigesci a malabsorpci jídla v tenkém střevě.
Co je enteropeptidáza?
Enteropeptidáza je enzym duodenální sliznice, který aktivuje trávicí enzymy slinivky břišní aktivací trypsinogenu na trypsin.
Enteropeptidáza je sekretována na okraji kartáče duodenální sliznice. Konkrétně jsou liebekühnovy žlázy zodpovědné za sekreci. Liebekühnovy žlázy jsou tubulární deprese v epitelu tenkého a tlustého střeva. V tenkém střevě jsou umístěny mezi tenkými střevními klky. Žlázy, také známé jako krypty Lieberkühna, vylučují kromě enteropeptidázy také velké množství enzymů. Sekrece enteropeptidázy je stimulována, když chyme, který byl předem štěpen v žaludku, vstoupí do dvanáctníku. Samotný enzym neovlivňuje složky potravin.
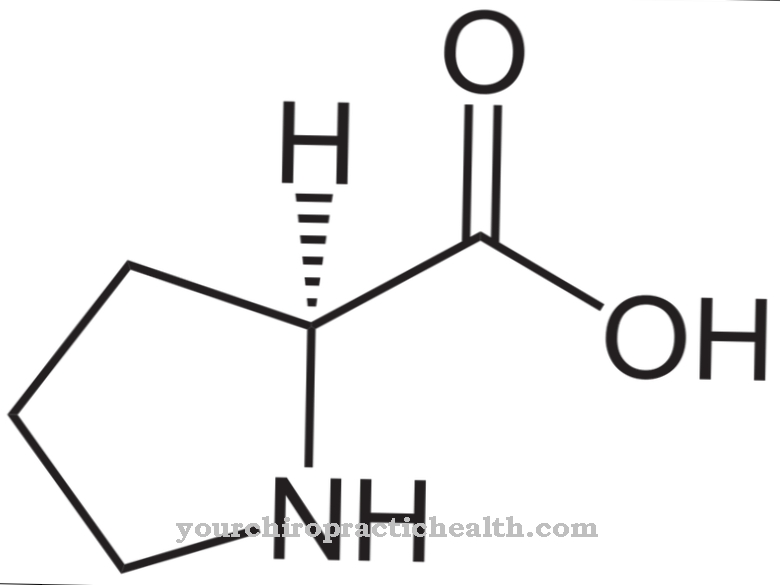
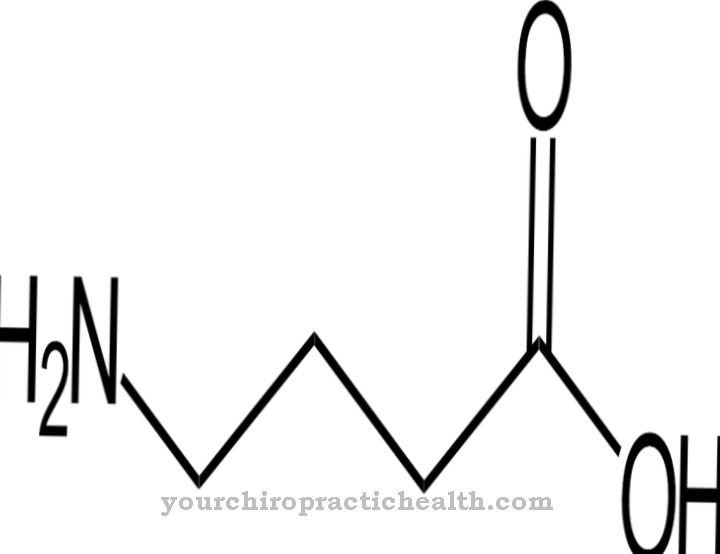
Pouze aktivace enzymu trypsin uvádí celou aktivační kaskádu trávicích enzymů do pohybu. Enteropeptidáza, stejně jako trypsin a další proteázy pankreatu, je serinová proteáza. Aktivní centrum obsahuje katalytickou triádu kyseliny asparagové, histidinu a serinu. Enteropeptidáza jako endopeptidáza štěpí proteiny pouze v určitých charakteristických bodech s určitými rozpoznávacími motivy v aminokyselinové sekvenci. Enzym vždy štěpí rozpoznávací motiv Asp-Asp-Asp-Asp-Lys. U trypsinogenu se štěpí hexapeptid Val- (Asp) 4-Lys, přičemž se vytvoří trypsin.
Funkce, efekt a úkoly
Funkce enteropeptidázy je aktivovat trávicí enzymy v pankreatu. Zahajuje pouze první krok aktivace přeměnou trypsinogenu na trypsin.
Trypsin je zase serinová proteáza, která štěpí proteiny na základě stejného charakteristického rozpoznávacího motivu. Nyní pokračuje v aktivaci samotného trypsinogenu. Současně aktivuje další pankreatické enzymy ze svých příslušných prekurzorů, jako je chymotrypsinogen, pro-elastáza, pro-karboxypeptidáza, pro-fosfolipáza a proenteropeptidáza. Enteropeptidáza je také zpočátku v neaktivní proformě. Když chyme vstupuje do duodena, vylučuje se nejen proenteropeptidáza, ale také duodenáza, která aktivuje proformu enteropeptidázy. Po zahájení aktivační kaskády přebírá trypsin aktivaci všech pankreatických enzymů včetně proenteropeptidázy a trypsinogenu.
K aktivaci proenteropeptidázy na enteropeptidázu dochází ještě účinněji působením trypsinu než prostřednictvím duodenázy. Primární přítomnost trávicích enzymů v jejich neaktivní formě je nesmírně důležitá. Účinek proteáz je zejména nespecifický. Všechny proteiny, které obsahují charakteristický rozpoznávací motiv v molekule, jsou hydrolyticky štěpeny. Pokud by byly enzymy okamžitě katalyticky aktivní, vlastní proteiny v těle by již byly štěpeny ve slinivce břišní a v pankreatu. V důsledku toho by se pankreas rozpustil. K aktivaci dochází pouze v duodenu mimo exokrinní žlázy.
Enzymy zde mohou začít rozkládat potravinové složky, aniž by útočily na vlastní tkáně těla. Aby se předešlo předčasné aktivaci enzymů, v kanálu pankreatu působí další inhibitor trypsinu. Klíčovou roli pro trávicí kaskádu však hraje trypsin. Jakmile je tento enzym aktivován, nelze zastavit aktivaci všech trávicích enzymů, včetně enteropeptidázy.
Vzdělávání, výskyt, vlastnosti a optimální hodnoty
Enteropeptidáza má stejně jako všechny serinové proteázy nespecifický účinek a štěpí proteiny pomocí charakteristického rozpoznávacího motivu. Enteropeptidáza sestává z lehkého a těžkého řetězce, které jsou spojeny disulfidovými můstky. Serinová proteázová doména je umístěna na lehkém řetězci.
Těžký řetězec má molekulovou hmotnost 82 až 140 kilodaltonů, s molekulovou hmotností lehkého řetězce 35 až 62 kilodaltonů. Struktura lehkého řetězce enteropeptidázy je podobná jako u ostatních serinových proteáz trypsin a chymotrypsin. Těžký řetězec je vázán na membránu a ovlivňuje specificitu enzymu. Bylo zjištěno, že izolovaný lehký řetězec má podobný účinek proti charakteristickému rozpoznávacímu motivu - (Asp) 4-Lys-, ale výrazně nižší účinek proti trypsinogenu.
Nemoci a poruchy
Lidská enteropeptidáza je kódována genem ENTK na chromozomu 21. Mutace tohoto genu může vést k vážným onemocněním postižených dětí.
Enzym již nemůže aktivovat další trávicí enzymy. Složky potravin se již nerozkládají, a proto již nemohou být absorbovány tenkým střevem. Je to především záležitost špatného trávení (nedostatečné zhroucení), které vede k malabsorpci složek potravin. Tělo již není dostatečně zásobováno živinami. Vyskytuje se selhání, vzkvétající růst a typické příznaky nedostatku bílkovin s vývojem otoků. Současně se kromě proteinů špatně vstřebávají sacharidy a tuky. Protože se nestrávené potravinové složky dostávají do tlustého střeva a jsou zde rozkládány fermentací a hnilobnými bakteriemi, dochází také k nadýmání, průjmu a bolesti břicha.
Dosud bylo celosvětově popsáno 15 případů vrozené enteropeptidázové deficience. Příznaky stavu jsou však mnohem běžnější. Deficit enteropeptidázy nemusí být vždy přítomen. Protože trypsin hraje klíčovou roli v aktivaci trávicích enzymů, vede defekt nebo nedostatek trypsinu k podobným příznakům. Léčba těchto chorob je v obou případech stejná. Enzymy se podávají v aktivované formě. Určitě existuje mnohem více nediagnostikovaných případů enteropeptidázového deficitu.
Pokud je diagnóza jistá, může být také substituována enteropeptidáza. Deficit enteropeptidázy je také způsoben sekundárně závažnými střevními chorobami.Nemoci, jako je celiakie, zkrácené tenké střevo, nedostatek laktázy nebo jiné, by měly být objasněny v diferenciální diagnostice.

.jpg)









.jpg)