Fibronectin je glukoprotein a hraje důležitou roli při udržování tělesných buněk pohromadě nebo při srážení krve. Přebírá v organismu mnoho různých funkcí, které souvisejí s jeho schopností vyvinout adhezivní síly. Strukturální chyby ve struktuře fibronektinu mohou vést k závažné slabosti pojivové tkáně.
Co je fibronektin?
Fibronektin je glukoprotein s molekulovou hmotností 440 kDa (kilodaltonů), který se používá k vývoji adhezivních sil mezi buňkami, mezi tělními buňkami a různými substráty, mezi tělními buňkami a mezibuněčnou matricí a mezi krevními destičkami během srážení krve. Podporuje tedy hojení ran, embryogenezi, hemostázi, buněčnou adhezi během buněčné migrace nebo vazbu antigenu na fagocyty.
Primární fibronektin obsahuje 2355 aminokyselin a tvoří 15 izoforem. Vyskytuje se jak v extracelulární oblasti, tak v tělních buňkách. Mimo buňky je to nerozpustný protein, uvnitř buněčné plazmy je to rozpustný protein. Všechny formy fibronektinu jsou kódovány stejným genem FN1. Rozpustný fibronektin obsahuje dva isomerní proteinové řetězce, které jsou spojeny disulfidovým můstkem. V případě nerozpustného fibronektinu jsou tyto molekuly opět navzájem spojeny disulfidovými můstky za vzniku struktury podobné vláknitým vláknům.
Anatomie a struktura
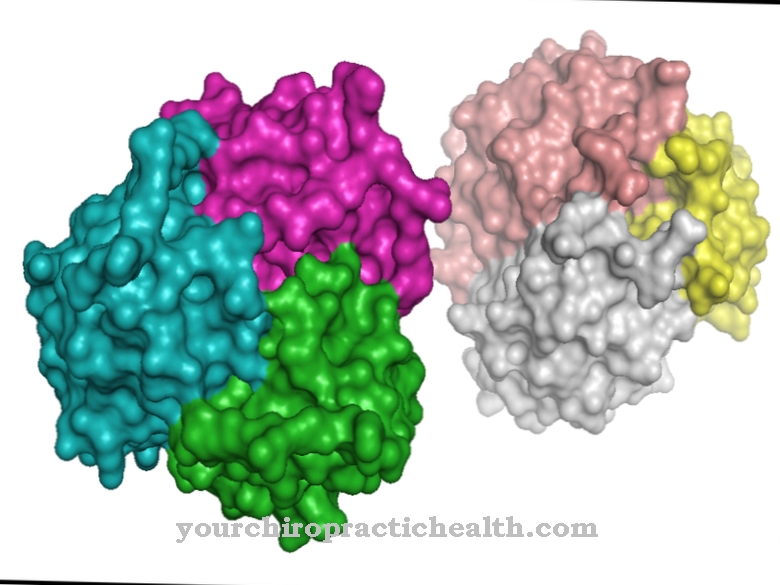
Ve své základní struktuře je fibronektin heterodimer tvořený dvěma tyčovitými proteinovými řetězci, které jsou spojeny disulfidovým můstkem. Izomerní proteinové řetězce jsou exprimovány stejným genem, FN1 genem. Odlišná sekvence bází vyplývá z alternativního sestřihu tohoto genu. Každý gen obsahuje exony a introny. Exony jsou řezy, které jsou přeloženy do proteinové struktury. Naproti tomu introny jsou neaktivní genové segmenty. Při alternativním sestřihu zůstává sekvence párů bází stejná, ale exony a introny se nacházejí na různých genových segmentech. Při překladu genetické informace se čitelné exony sloučí a introny se vyříznou. Tento alternativní překlad stejné genetické informace umožňuje vytvoření několika izomerních proteinových řetězců ze stejného genu.
Fibronektin, složený ze dvou izomerních proteinových řetězců, je rozpustný, tvoří se v játrech a vstupuje do krevní plazmy. Tam je zodpovědný za koagulaci krve v rámci hojení ran a regenerace tkání. Nerozpustný fibronektin je produkován v makrofázích, endoteliálních buňkách nebo fibroblastech. Obsahuje stejnou základní strukturu. Zde jsou však jednotlivé molekuly fibronektinu zase navzájem spojeny disulfidovými můstky za vzniku fibrilárních proteinových struktur, které drží buňky pohromadě.
Schopnost vyvíjet adhezivní síly je způsobena často se vyskytující aminokyselinovou sekvencí arginin - glycin - aspartát. To vede k adhezi fibronektinu na tzv. Integriny (receptory adheze na povrchu buněk). Proteinové řetězce fibronektinu jsou tvořeny mnoha doménami, které obsahují 40 až 90 aminokyselin. Vzhledem k homologii domén jsou fibronektinové polypeptidové řetězce rozděleny do tří strukturních typů I, II a III.
Funkce a úkoly
Fibronektin obecně slouží k udržení určitých strukturálních jednotek pohromadě. Patří sem buňky, extracelulární matrice, určité substráty nebo dokonce krevní destičky. Fibronektin byl nazýván Buněčné lepidlo určený. Zajišťuje, aby buňky v tkáních zůstaly pohromadě a neroztahovaly se.
Hraje také hlavní roli v buněčné migraci. Dokonce i dokování makrofágů antigeny je zprostředkováno fibronektinem. Dále fibronektin řídí mnoho procesů embryogeneze a buněčné diferenciace.
U maligních nádorů je však fibronektin často redukován. To umožňuje nádoru růst do tkáně a vytvářet metastázy rozštěpením nádorových buněk.
Rozpustný fibronektin v krevní plazmě umožňuje tvorbě krevních sraženin k uzavření krvácejících ran. Jednotlivé krevní destičky jsou slepeny dohromady vytvářením fibrinu. Jako opsonin se fibronektin váže na povrch makrofágů jako receptory. S pomocí těchto receptorů se makrofágy mohou vázat a inkorporovat určité částice způsobující onemocnění. V extracelulárním prostoru je nerozpustný fibronektin zodpovědný za tvorbu matrice, která fixuje buňky.
Nemoci
Nedostatek nebo strukturální abnormality fibronektinu mají často závažné zdravotní účinky. V důsledku růstu rakoviny v nádoru koncentrace fibronektinu klesá. Buněčná struktura v nádoru se uvolní a buňky se od sebe vzdálí. To vede k častým metastázám v důsledku štěpení nádorových buněk a jejich migraci lymfatickým systémem nebo krevní plazmou do jiných částí těla. Navíc z důvodu nedostatku fibronektinu mohou rakovinné buňky růst do sousední tkáně rychleji, a tak je vytlačovat.
Kromě toho existují dědičná onemocnění, která vedou k poškození pojivové tkáně. Příkladem je Ehlers-Danlosův syndrom. Ehlers-Danlosův syndrom není jednotné onemocnění, ale spíše představuje komplex defektů pojivové tkáně, typ X je způsoben chybějícím nebo vadným fibronektinem. Jedná se o mutaci v genu FN1. To vede k drastické slabosti pojivové tkáně. Podmínka je zděděna jako autozomálně recesivní vlastnost. Projevuje se ve velmi povislé kůži a nadměrné pohyblivosti kloubů. Přes velké rozdíly v příčině slabé pojivové tkáně jsou příznaky jednotlivých onemocnění tohoto komplexu podobné. Podle dánského dermatologa Edvarda Ehlerse a francouzského dermatologa Henriho-Alexandra Danlose jsou kardinálními příznaky Ehlers-Danlosova syndromu silná přebíjitelnost a čajová snášenlivost kůže.
Konečně, určitá mutace v genu FN1 může také vést ke glomerulopatii (onemocnění ledvinových tělísek). Jedná se o závažné onemocnění ledvin, které často vyžaduje léčbu dialýzou.






.jpg)



.jpg)