Mezní potenciál popisuje specifický rozdíl náboje na membráně excitovatelných buněk. Pokud membránový potenciál v průběhu depolarizace oslabuje na určitou hodnotu, vyvolává se akční potenciál otevřením iontových kanálů závislých na napětí. Hodnota, která má být v každém případě nezbytná pro vytvoření akčního potenciálu, je nezbytná pro vedení excitace díky principu „vše nebo nic“.
Jaký je prahový potenciál?

Buněčný vnitřek je oddělen od okolního vnějšího média membránou, která je jen částečně prostupná pro určité látky. To znamená, že ionty, tj. Nabité částice, nemohou projít skrz ně nekontrolovaným způsobem. Kvůli nerovnoměrnému rozdělení iontů mezi vnitřkem a vnějšku článku se vytváří měřitelný elektrochemický potenciál, který se označuje jako prahový potenciál.
Dokud není buňka stimulována, je tento klidový membránový potenciál negativní. Elektrický impuls přicházející do buňky jej aktivuje nebo uvede do vzrušeného stavu. Negativní klidový membránový potenciál je depolarizován změnou propustnosti iontů, tj. Pozitivnější. To, zda nastane nervová odpověď, závisí na rozsahu této předepolarizace. Podle principu „vše nebo nic“ je akční potenciál vytvořen pouze tehdy, když je dosaženo nebo překročeno určité kritické hodnoty. Jinak se nic nestane. Tato specifická hodnota nezbytná pro vedení buzení pomocí akčních potenciálů se označuje jako prahový potenciál.
Funkce a úkol
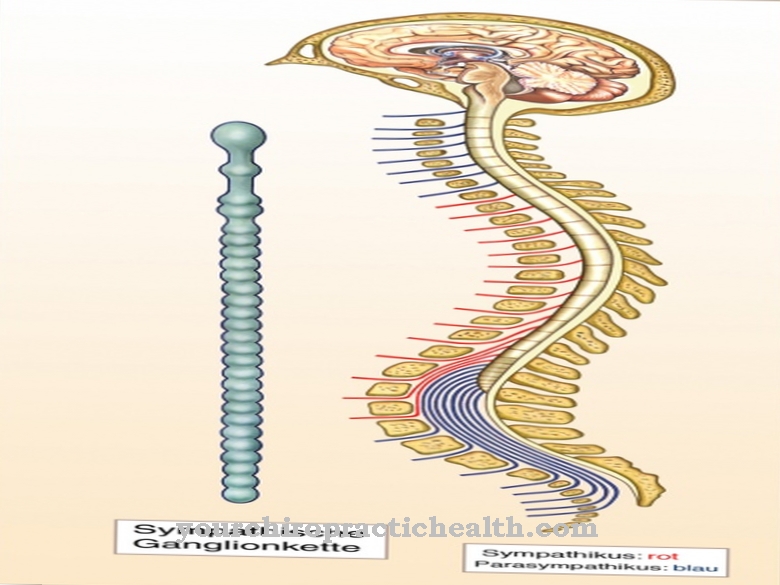
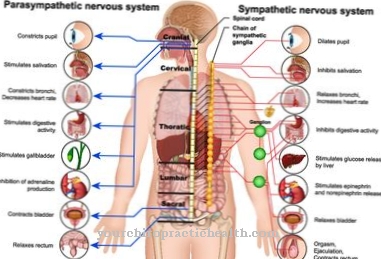
Kontaktním bodem pro všechny přicházející excitační impulzy je val z axonu. To označuje místo, kde se vytváří akční potenciál, protože prahový potenciál je zde nižší než na jiných sekcích membrány kvůli zvláště vysoké hustotě iontových kanálů závislých na napětí.
Jakmile je prahový potenciál dosažen nebo překročen v průběhu před depolarizace, dochází k určité řetězové reakci. Náhle se otevře velký počet sodíkových iontových kanálů závislých na napětí. Dočasný, lavinou podobný přítok sodíku podél gradientu napětí zesiluje depolarizaci až do úplného kolapsu klidového membránového potenciálu. Je stanoven akční potenciál, tj.po dobu asi milisekundy způsobuje přebytek kladných nábojů uvnitř buňky obrácení polarity.
Po úspěšném spuštění akčního potenciálu se původní membránový potenciál postupně obnovuje. Zatímco přítok sodíku je pomalý, otevřené zpožděné draslíkové kanály jsou otevřené. Zvyšující se odtok draslíku kompenzuje klesající příliv sodíku a působí proti depolarizaci. V průběhu této takzvané repolarizace se membránový potenciál stává opět negativním a dokonce krátce klesne pod hodnotu klidového potenciálu.
Pumpa sodík-draslík pak obnovuje původní distribuci iontů. Excitace se šíří ve formě akčního potenciálu přes axon k další nervové nebo svalové buňce.
Budicí vedení probíhá konstantním mechanismem. Pro kompenzaci depolarizace migrují sousední ionty na místo, kde se vytváří akční potenciál. Tato migrace iontů také vede k depolarizaci v sousedním regionu, což vyvolává nový akční potenciál se zpožděním, když je dosaženo prahového potenciálu.
V neuronech bez myelinu lze pozorovat kontinuální přenos excitace podél membrány, zatímco excitace skočí z kruhu na kruh v nervových vláknech, která jsou obklopena myelinovým obalem. Příslušný úsek membrány, na kterém je spuštěn akční potenciál, nemůže být excitován, dokud není obnoven klidový membránový potenciál, který umožňuje, aby excitace byla přenesena pouze v jednom směru.
Nemoci a nemoci
Prahový potenciál je předpokladem pro vytvoření akčních potenciálů, na nichž je nakonec založen celý přenos nervových impulsů nebo buzení. Protože vedení excitace je nezbytné pro všechny fyziologické funkce, jakékoli narušení této citlivé elektrofyziologie může vést k fyzickým omezením.
Hypokalémie, tj. Nedostatek draslíku, má zpomalující účinek na depolarizaci a urychluje repolarizaci oslabením klidového membránového potenciálu, který je spojen s pomalejším vedením excitace a rizikem slabosti nebo ochrnutí svalů. U nemocí, které poškozují myelinový obal nervových vláken (např. Roztroušená skleróza), jsou exponovány draslíkové kanály, které jsou v pozadí, což má za následek nekontrolovaný odtok draslíkových iontů zevnitř buňky, a tím také úplnou absenci nebo oslabení akčního potenciálu.
Kromě toho mohou genetické mutace v kanálových proteinech pro sodík a draslík způsobit různé funkční poruchy různého stupně v závislosti na poloze postižených kanálů. Například defekty draslíkových kanálů ve vnitřním uchu jsou spojeny se ztrátou sluchu ve vnitřním uchu. Patologicky změněné sodíkové kanály v kosterních svalech způsobují tzv. Myotonii, která se vyznačuje zvýšeným nebo trvalým napětím a zpožděnou relaxací svalů. Důvodem je nedostatečné uzavření nebo zablokování sodíkových kanálů a tím vytvoření nadměrného akčního potenciálu.
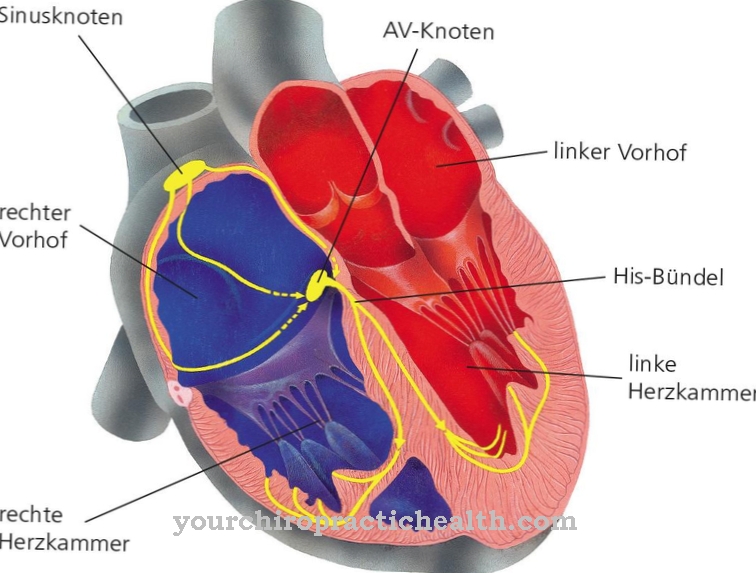
Porucha sodíkových nebo draslíkových kanálů v srdečních svalech může vyvolat arytmie, tj. Srdeční arytmie, jako je zvýšená srdeční frekvence (tachykardie), protože pouze správné vedení excitace v srdci zaručuje stabilní, nezávislý srdeční rytmus. V případě tachykardie mohou být narušeny různé prvky v transmisním řetězci: například rytmus automatické depolarizace nebo časové propojení depolarizace svalových buněk nebo frekvence excitace v důsledku nedostatku klidových fází.
Terapie se zpravidla provádí blokátory sodíkových kanálů, které inhibují příliv sodíku a tím na jedné straně stabilizují membránový potenciál a na druhé straně zpožďují opětovnou excitaci buňky. V zásadě lze selektivně blokovat všechny typy iontových kanálů. V případě sodíkových kanálů závislých na napětí se to provádí pomocí tzv. Lokálních anestetik. Neurotoxiny, jako je jed mamby (dendrotoxin) nebo jed pufru (tetrodotoxin), však mohou snížit nebo vypnout excitabilitu buňky inhibováním přítoku sodíku a zabráněním rozvoje akčního potenciálu.









.jpg)



.jpg)