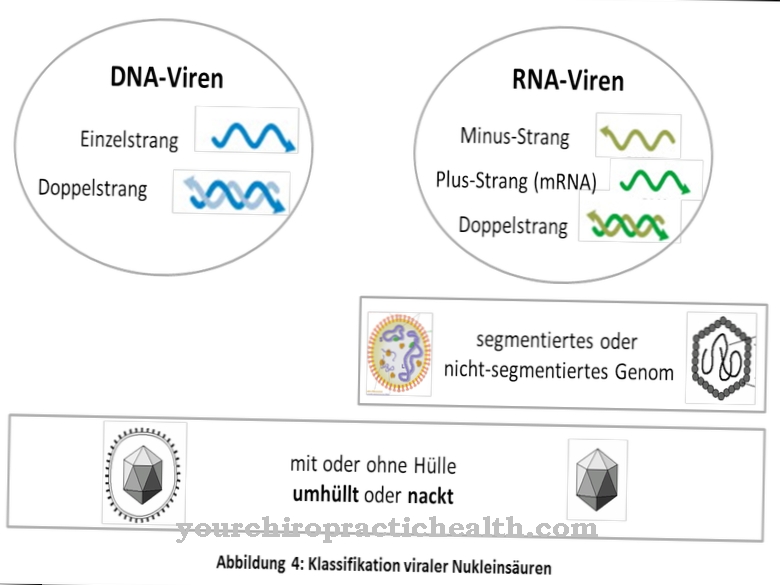
Tak jako Prorok fágová DNA mírných bakteriofágů se nazývá, když je přítomna v bakteriální hostitelské buňce. Bakteriofágy objevil Félix Hubert d´Hérelle v roce 1917. Jsou to viry, které se přizpůsobily specifickým bakteriím. V dalším průběhu výzkumu bylo rozlišováno mezi lytickým fágem s vysokou virulencí a mírným fágem s tichým proroctvím a lysogenním cyklem.
Co jsou proroci?
Prorok mírného bakteriofága může být přítomen jako plazmid v hostitelské buňce nebo integrován do bakteriální DNA. Za tímto účelem musí mírný fág při injekci fágové DNA přijmout lysogenní cyklus. Rozlišuje se mezi lytickým cyklem a lysogenním cyklem. Zatímco lytický cyklus způsobuje rychlou replikaci a následnou lýzu hostitelské buňky po injekci genetického materiálu, do lysogenního cyklu se do hostitelské buňky injikují represorové geny fágu, aby se potlačil lytický cyklus, tj. Rychlé rozpuštění buňky.
Mírný fág může přepínat mezi lytickým a lysogenním cyklem v závislosti na převládajících podmínkách prostředí. Lytický cyklus se týká obvyklého způsobu, jak fágové geny pracují v hostitelské buňce. Po injekci virové DNA dochází k rychlé replikaci v hostitelské buňce. Poté, co se proteiny kapsidy a ocasních vláken replikují navíc k virové DNA a z jednotlivých částí se shromáždí četné nové virové částice, buněčná stěna hostitelské buňky se rozloží lysozymem. Když se buněčná stěna rozpustí, uvolní se nové fágy a jejich DNA může být nyní injikována do jiných bakteriálních buněk. Tento proces je dokončen asi za hodinu.
Vzhledem k vysokému počtu nových virových částic je tento přístup označován jako „virulentní forma“. Protože buněčná zeď hostitele je zničena pomocí lysozymu, používá se termín "lytický cyklus". V případě mírného fágu nemusí nutně dojít k rychlé replikaci a následné lýze hostitelské buňky. V závislosti na existujících faktorech prostředí může mírný fág přepínat mezi lytickým a lysogenním cyklem. Lytický cyklus může být potlačen vstříknutím represorových genů a lysogenní cyklus může začít donekonečna.
V lysogenním cyklu je fágový genetický materiál vložen do genetického materiálu bakterie a může zde přežít po neurčitou dobu. Injektovaný genetický materiál je označován jako „stále“ a je definován jako „proroctví“. Prorok může ležet jako plazmid v cytoplazmě hostitelské buňky nebo může být integrován do genetického materiálu bakterie.
Integrace virového genetického materiálu vyžaduje vysokou míru specializace. Genom mírných fágů lze připojit pouze k určitým pozicím v bakteriální DNA. Naopak, genetický materiál jednotlivých mírných fágových kmenů lze vždy identifikovat na stejných místech bakteriálního genomu.
Díky úspěšné adaptaci profitují profágy z dělení bakteriálních buněk. Když hostitelská buňka dělí mitózu, virový genetický materiál se přenáší dále. Další přenos na jiné bakterie může probíhat konjugací. Proroky se tak mohou šířit různými přenosovými cestami přes celé bakteriální kmeny. Kvůli vlivům prostředí, jako je UV záření nebo určité chemikálie, se může prorok přepnout zpět do lytického cyklu a usilovat o agresivní replikaci.
Proroctví také využívá transkripční procesy hostitelské buňky: vstříknuté represorové geny fágu jsou rozpoznávány jako poškození DNA některými enzymy bakterie a jsou rozkládány. Degradace represorových genů je v hostitelské buňce samozničující. Lytický cyklus již nemůže být potlačen a profáze se mění z lysogenního stavu na agresivní replikaci, která končí následným rozpuštěním bakteriální buněčné stěny.
Výskyt, distribuce a vlastnosti
Fágy jsou vysoce specializované viry, které se přizpůsobily jednotlivým kmenům bakterií. Takže ne každý bakteriofág má přístup ke každé bakterii. Násobení bez specifické hostitelské buňky pro bakteriofág není možné. Vysoká úroveň specializace znamená, že bakteriofágy lze nalézt ve stejném terénu jako jejich hostitelské buňky.
Totéž platí i pro proroctví. Protože profágy nejsou konvenční viry a vyskytují se pouze jako virový dědičný materiál v hostitelském organismu, nemohou být díky samotné definici nalezeny mimo přiřazené buňky.
Kromě toho je třeba zmínit, že bakteriofágy samotné v mořské vodě mají řadu (10 až 30), a tak na celé planetě je přítomno více fágů než živé bytosti. Na rozdíl od toho existuje velmi malé množství devatenácti oficiálně zkoumaných bakteriofágů, což ztěžuje přesné vyjádření o výskytu.
Význam a funkce
Fágová terapie byla vyvinuta ve 20. letech 20. století a ve východní Evropě se úspěšně používá k boji proti různým infekčním onemocněním dodnes. Výhody fágové terapie jsou zřejmé: bakteriofágy poškozují pouze jednotlivé bakteriální kmeny, zatímco antibiotika mají obecně škodlivý účinek na bakterie v těle.
Objev penicilinu ve 40. letech 20. století vedl k masivnímu používání antibiotik na Západě a v důsledku toho k ukončení fágového výzkumu. Následné zvyšování řady antibiotických rezistencí vyvolalo v 90. letech zvýšený zájem o bakteriofágy.
Fágová terapie se zaměřuje na bakteriofágy s agresivní virulencí a výhradně lytickým cyklem, zatímco mírné bakteriofágy a profágy hrály dosud jen podřízenou roli.
Nemoci a nemoci
Některé patogeny si mohou vybudovat svou virulenci pouze symbiózou s proroctvími. Clostridium botulinum může produkovat obávaný botulotoxin pouze pomocí integrované fágové DNA. Streptococcus pyogenes může vyvolat šarlatovou horečku pouze v kombinaci s profágovou DNA.
Vibrio cholerae produkuje choleru pouze pomocí speciálních proroctví. To také ukazuje důležitost fágů pro humánní medicínu. Celé bakteriální kmeny by mohly ztratit svůj patogenní potenciál, pokud by mohly být zodpovědné profágy specificky vypnuty.













.jpg)