Lysylhydroxylázy Představují skupinu enzymů, které jsou zodpovědné za hydroxylaci zbytků lysinu v proteinech. Přispívají tedy hlavně ke struktuře pojivové tkáně. Poruchy funkce lysylhydroxyláz se projevují u nemocí, jako jsou kurděje nebo dědičný Ehlers-Danlosův syndrom.
Co jsou to lysylhydroxylázy?
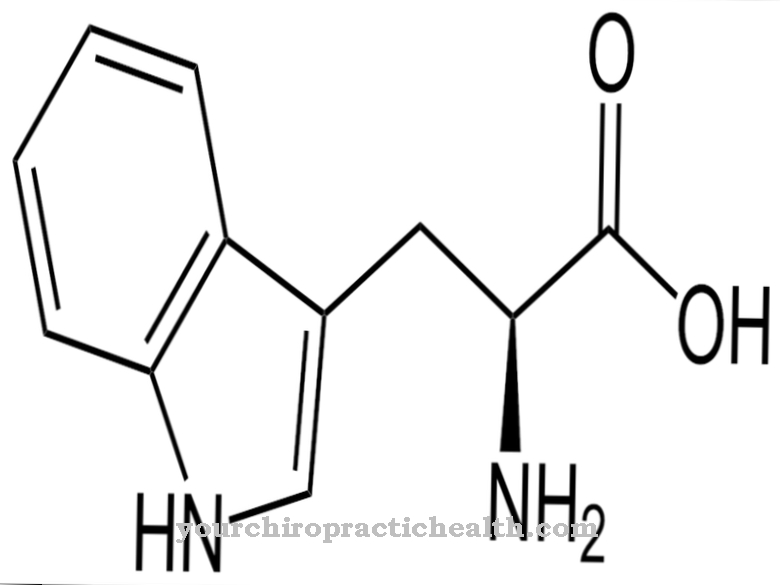
Lysylhydroxylázy jsou enzymy, jejichž úkolem je katalyzovat posttranslační modifikaci aminokyseliny lysinu začleněním hydroxylové skupiny do hydroxy lysinu. To posiluje pojivovou tkáň, protože její proteinové řetězce mají příležitost dále se propojovat prostřednictvím hydroxylových skupin.
Lidská lysylhydroxyláza sestává ze 727 aminokyselin. Lysylhydroxylázy také patří do skupiny hydroxylas, tj. Enzymů, které obecně katalyzují inkorporaci hydroxylových skupin do molekul. Kromě lysylhydroxyláz zahrnují hydroxylázy nebo oxidoreduktázy také prolylhydroxylázy, fenylalaninhydroxylázy, tyrosinhydroxylázy nebo tryptofanhydroxylázy. Zejména společně s prolylhydroxylázy, lysylhydroxylázy hrají důležitou roli ve funkci pojivové tkáně. Obě enzymové skupiny vyžadují pro svou funkci koenzymový vitamin C.
Funkce, efekt a úkoly
Funkce lysylhydroxyláz spočívá výhradně v katalyzování inkorporace hydroxylových skupin do zbytků lysinu v proteinu. V průběhu posttranslační modifikace je aminokyselina hydroxylamin vytvořena z lysinu.
I když je hydroxylamin také volný, nemůže být v této formě inkorporován do proteinu. Posttranslační modifikace tedy znamená následnou přeměnu této aminokyseliny po vytvoření proteinu. Když je atom vodíku nahrazen za hydroxylovou skupinu, v tomto bodě je do proteinu zabudována funkční skupina, která může vykonávat přemostění. S pomocí hydroxylové skupiny se mohou spojit různé proteinové řetězce. Kromě toho se na tuto funkční skupinu mohou vázat molekuly cukru. Obě reakce jsou velmi důležité, mimo jiné, ve vývoji pojivové tkáně.
Pojivová tkáň obklopuje organismus a vnitřní orgány. Musí být pevná a napnutá, aby mohla rozlišovat mezi funkčně odlišnými orgány. To je zajištěno proteiny pojivové tkáně, které obsahují vysoké procento aminokyselin lysin a prolin.Za tímto účelem jsou obě aminokyseliny následně po inkorporaci do proteinu částečně modifikovány přidáním hydroxylové skupiny. Jak již bylo uvedeno, s prolinem je tato reakce katalyzována prolylhydroxylázami a lysinem lysylhydroxylázy. Po vytvoření proteinu tyto modifikační reakce vytvářejí síť proteinových řetězců, které představují pevnou pojivovou tkáň.
Bez funkce obou enzymů by vývoj funkční pojivové tkáně nebyl vůbec možný. Oba enzymy však fungují pouze za pomoci kyseliny koenzymové askorbové, tj. Vitamínu C. Při strukturně změněných enzymech mutací nebo nedostatkem vitamínu C to může vést k narušení struktury pojivové tkáně a tím k vážným onemocněním.
Vzdělávání, výskyt, vlastnosti a optimální hodnoty
Gen PLOD1 je zodpovědný za kódování lidské lysylhydroxylázy. Název PLOD1 je odvozen od názvu lysylhydroxylázy "Prokollagen-Lysin, 2-Oxoglutarat-5-Dioxygenase 1". Tento gen je umístěn na chromozomu 1. Protože se neustále vytváří nová pojivová tkáň, existuje také stálá potřeba produkce lysylhydroxyláz. Mutace tohoto genu tedy může mít velmi závažné důsledky pro zdraví organismu.
Nemoci a poruchy
Poruchy funkce lysylhydroxyláz hrají obzvláště důležitou roli u kurděje a Ehlers-Danlosova syndromu. Scurvy je známý jako starověké mořské onemocnění, které je způsobeno nedostatkem vitamínu C. Vitamin C, také známý jako kyselina askorbová, funguje jako koenzym lysylhydroxyláz a prolylhydroxyláz. Pokud chybí, aminokyseliny lysin a prolin v proteinu pojivové tkáně již nemohou být hydroxylovány.
Protože dochází k neustálému nárůstu a rozkladu proteinů pojivové tkáně, jsou proteinové řetězce v období nedostatku vitaminu stále méně schopné sítě. Pojivová tkáň se uvolní a již nemůže správně plnit svou funkci. Objevují se různé příznaky, včetně obecného vyčerpání, náchylnosti k infekcím, krvácení z dásní, ztráty zubů, špatného hojení ran, závažných kožních problémů, úbytku svalů a mnoha dalších poškození zdraví. Scurvy může nakonec vést k úmrtí na všeobecné srdeční selhání nebo těžké infekce. Starověcí námořníci byli zvláště zasaženi, protože během dlouhých plaveb na moři nemohli získat dostatek vitamínu C.
Ukázalo se, že nemoc se okamžitě uzdraví, když se podávají určité potraviny, jako je například zelí. Až později bylo zjištěno, že příčinou onemocnění byl nedostatek vitamínu C. Vypuknutí kurdějské choroby námořníků bylo později zabráněno krmením námořníků zelím. Jiným onemocněním, které lze jen částečně přičíst defektu lidské lysylhydroxylázy, je Ehlers-Danlosův syndrom. Ehlers-Danlosův syndrom je kolektivní termín pro různé dědičné choroby pojivové tkáně s různými příčinami. Tento syndrom je charakterizován závažnou slabostí pojivové tkáně.
Kůže je přetažitelná a klouby jsou přetahovatelné. Geneticky modifikovaná lysylhydroxyláza spouští Ehlers-Danlosův syndrom typu VI. Za to odpovídá mutovaný gen nazývaný PLOD1, který je umístěn na chromozomu 1. Defektní enzym vytvořený z toho již není plně funkční a může nedostatečně katalyzovat hydroxylační reakce na lysinu. Slabá pojivová tkáň se vyvíjí se známými příznaky, jakož i dalším postižením očí a vnitřních orgánů. Ehlers-Danlosův syndrom typu VI může být zděděn jako autozomálně recesivní rys.





.jpg)



.jpg)





.jpg)
.jpg)

.jpg)