Trypsin Jako enzym slinivky břišní je zodpovědný za další rozklad potravinových bílkovin. Funguje v silně alkalickém rozsahu. Nedostatek trypsinu vede k nedostatku bílkovin v těle v důsledku zhoršeného trávení bílkovin.
Co je trypsin?
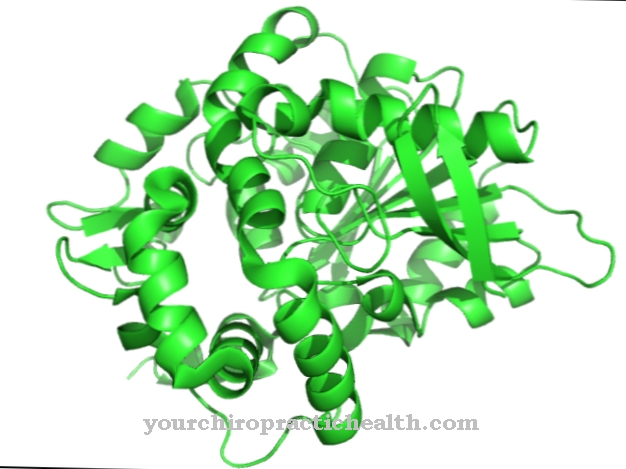
Trypsin je proteáza, která pokračuje v rozkladu proteinů v alkalické oblasti tenkého střeva. V žaludku začíná rozklad proteinu v kyselém prostředí enzymem pepsinem. Enzym trypsin se skládá ze tří složek.
Jedná se o trypsin-1 jako kation, trypsin-2 jako anion a trypsin-4. Dvě třetiny enzymu sestávají z trypsinu-1 a jedné třetiny trypsinu-2. Trypsin-4 nebo mesotrypsin se vyskytují pouze v malém množství. Trypsin je endoproteáza. Rozděluje protein pouze na určitých místech. Je to také serinová proteáza. Jeho aktivní centrum obsahuje katalytickou triádu kyseliny asparagové, histidinu a serinu. Rozděluje potravinové proteiny přednostně na bazické aminokyseliny lysin, arginin a modifikovaný cystein.
Trypsin se vyrábí z prekursoru zymogenního trypsinogenu pomocí katalytického působení střevního enzymu enteropeptidázy. Enzym sestává z 224 aminokyselin. Trypsin vyvíjí svůj optimální účinek při hodnotě pH 7 až 8.
Funkce, efekt a úkoly
Úkolem trypsinu je pokračovat v rozkladu proteinů, které již začaly v žaludku v alkalickém rozmezí. V žaludku začíná před trávením potravinových proteinů podobným enzymem pepsinem v kyselém rozmezí.
I zde jsou proteinové řetězce v určitých bodech přerušeny. Zatímco k tomuto štěpení proteinů dochází v žaludku na aromatických aminokyselinách, jako je fenylalanin, jsou proteiny a polypeptidy štěpeny trypsinem na základní aminokyseliny lysin a arginin, jakož i na modifikovaný cystein. Další rozdíl oproti pepsinu je v tom, že trypsin vyvíjí svůj optimální účinek v alkalickém rozmezí při hodnotě pH 7 až 8. Aktivovaný trypsin také převádí další zymogeny, jako je chymotrypsinogen, pro-elastáza, prokarboxypeptidáza a další neaktivní enzymy na aktivní enzymy.
Konverze začíná okamžitě po uvolnění trypsinu. Dalšími proteázami slinivky břišní jsou chymotrypsin, karboxypeptidáza nebo elastin. Kromě toho se trypsin aktivuje sám přeměnou trypsinogenu. Enzymy pankreatu jsou zpočátku ve své neaktivní formě, aby nedošlo k rozkladu slinivky břišní prostřednictvím trávení. Pouze když jsou neaktivní předlisky vylučovány, mohou být aktivovány rozdělením. Za prvé, přeměna trypsinogenu na trypsin je katalyzována enteropeptidázou. To je jediná funkce enteropeptidázy.
Hexamer s koncovou aminokyselinou lysinem se oddělí od trypsinogenu. Protože trypsin také štěpí polypeptidové řetězce na základním lysinu, nyní také katalyzuje svou vlastní aktivaci a současně aktivaci dalších zymogenů. Spolu s enzymy chymotrypsin a elastáza štěpí větší proteiny v tenkém střevě a peptony (polypeptidové řetězce) produkované působením pepsinu na tri- a dipeptidy. Tyto menší peptidy se potom pomocí dalších enzymů dále dělí na aminokyseliny. Zejména trypsin také přispívá k rozkladu aminokyseliny methioninu. Lysin stimuluje mimo jiné tvorbu trypsinu.
Vzdělávání, výskyt, vlastnosti a optimální hodnoty
Trypsin je endogenní enzym, který se používá k trávení potravinových bílkovin. To je důvod, proč je slinivka břišní vylučována krátce po jídle. Enzym však může být také získán z živočišných zdrojů a používán léčivě. Účinek štěpení bílkovin lze mimo jiné použít k rozkladu proteinových komplexů těla. Takto lze imunitní komplexy vyřešit při autoimunitních onemocněních.
Zánět v muskuloskeletálním systému lze také dobře léčit trypsinem. Aktivuje také enzym plasmin z plasminogenu. Plazmin rozpouští fibrin, když je silná tvorba trombu. S pomocí trypsinu lze léčit nebo dokonce zabránit trombóze. Kromě toho trypsin podporuje trávení při jídle. Při aplikaci 1 až 2 hodiny před jídlem nebo po jídle rozvine jeho protizánětlivé účinky.
Nemoci a poruchy
V kontextu pankreatické nedostatečnosti může být omezena syntéza trávicích enzymů, jako je trypsin. Důsledkem je rozvoj trávení. Kromě proteáz produkuje pankreas také lipázy a amylázy.
Pokud enzymy chybí, složky potravin již nejsou tráveny a končí v tlustém střevě. Například, pokud je nedostatek trypsinu, protein ve stravě již nemůže být řádně tráven. Putrefaktivní bakterie se usazují v tlustém střevě a anaerobně štěpí proteiny. Existují masivní zažívací potíže s nadýmáním, průjmem a bolestmi břicha. Kromě toho snížená tvorba aminokyselin vede k dostatečnému nedostatku bílkovin a podvýživě navzdory dostatečnému příjmu potravy. Enzymy však mohou být dodávány také zvnějšku.
Existují však také lékařské nouzové situace, ve kterých vlastní enzymy těla, jako je trypsin, tráví pankreas sám. To se může stát, pokud jsou žlučové a pankreatické kanály zablokovány. Trypsin se uvolňuje, ale nemůže se dostat do tenkého střeva prostřednictvím pankreatické blokády. Pokud pankreatický kanál není otevřen v této akutní nouzové situaci, bude výsledek fatální kvůli samovolnému rozpuštění slinivky břišní. I u pankreatických nádorů může být pankreatický kanál zcela nebo částečně uzavřen. Působení zažívacích šťáv v pankreatu se projevuje jako chronická nebo akutní pankreatitida.
Nedostatek trypsinu může být také způsoben mutací. Při narušení odbourávání trypsinu existují také dědičné formy pankreatitidy.






.jpg)





.jpg)




.jpg)
