Asi polovina všech proteinů je v lidském těle Glykoproteiny. Látky hrají roli jak buněčných složek, tak imunitních látek. Jsou tvořeny hlavně jako součást tzv. N-glykosylace a mohou způsobit vážné choroby, pokud nejsou správně sestaveny.
Co jsou glykoproteiny?
Glykoproteiny jsou proteiny s větvenými heteroglykanovými zbytky podobnými stromu. Obvykle mají viskózní konzistenci. Makromolekuly obsahují kovalentně vázané cukerné skupiny.
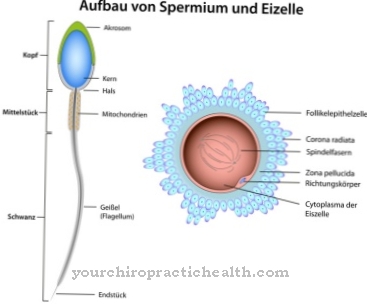
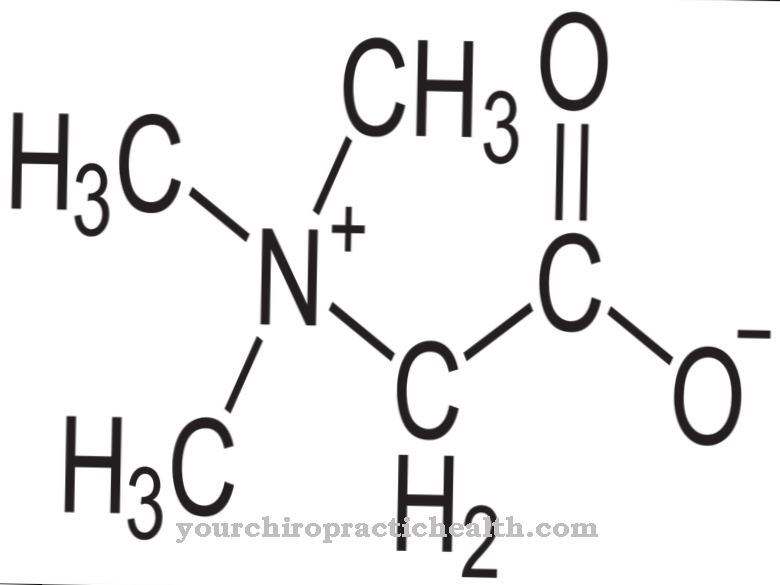
Skládají se z monosacharidů, jako je glukóza, fruktóza, manóza nebo acetylovaný aminový cukr. Proto jsou také známé jako oligosacharidy vázané na proteiny. Kovalentní vazba může probíhat různými způsoby a odpovídá buď vazbě na aminokyseliny serin nebo asparagin. Vazba na serin se nazývá O- a to na asparaginovou N-glykosylaci. Glykoproteiny podílející se na N-glykosylaci se liší velikostí. Odpovídají monosacharidům, di- nebo oligosacharidům a dokonce i polysacharidům.
Podle podílu monosacharidů se dělí na vysoce manosové, komplexní a hybridní glykoproteiny. Ve skupině bohaté na manosu převládají zbytky manosy. Ve složité skupině převládají sacharidy. Hybridní skupina je hybrid. Obsah uhlohydrátů v glykoproteinech je mezi několika procenty pro ribonukleázy a až 85 procenty pro antigeny krevních skupin.
Funkce, efekt a úkoly
Glykoproteiny plní v lidském organismu řadu funkcí. Jsou strukturální složkou buněčných membrán a v této souvislosti jsou také označovány jako strukturální proteiny. Nacházejí se také v hlenu a používají se jako mazadla v kapalinách.
Jako membránové proteiny přispívají k buněčné interakci. Některé glykoproteiny mají také hormonální funkce, jako je růstový faktor hCG. Látky jsou stejně důležité jako imunologické složky ve formě imunoglobulinů a interferonů. Všechny exportní proteiny a membránové proteiny v těle byly ještě glykoproteiny, alespoň během biosyntézy. Jsou zvláště důležité pro rozpoznávací reakce v imunitním systému, protože interagují s imunologickými T buňkami a receptory T buněk. V lidské krevní plazmě byly izolovány různé plazmatické proteiny, z nichž pouze albumin a prealbumin neobsahují žádné zbytky cukru.
Množství glykoproteinů je úžasné. Nakonec téměř všechny extracelulárně rozpustné proteiny a enzymy obsahují zbytky cukru. Jako hormony mají glykoproteiny pleiotropní účinek, a proto jsou rozhodující pro aktivitu různých orgánových systémů. Hormony TSH, HCG a FSH jsou například glykoproteiny. Jako membránové proteiny jsou zastoupeny v roli receptorů a také transportérů a stabilizátorů. Mají stabilizační účinek, zejména společně s glykolipidy. Společně s těmito látkami tvoří tzv. Glykokalyx, který stabilizuje buňky bez buněčné stěny.
Vzdělávání, výskyt, vlastnosti a optimální hodnoty
Nejběžnější tvorbou glykoproteinů je N-glykosidická vazba nebo N-glykosylace na asparagin. Cukr se váže na amidové skupiny neobsahující dusík. N-glykosylace probíhá v endoplazmatickém retikulu. Takto vytvořené N-glykosidy jsou nejdůležitější glykoproteinovou skupinou.
Při N-glykosylaci prekurzor cukru snythetizuje na nosné molekule dolichol, nezávisle na aminokyselinové sekvenci cílového proteinu. Skupina OH na konci molekuly je spojena s difosfátem. Oligosacharidový prekurzor je tvořen na koncovém fosfátovém zbytku molekul. Prvních sedm cukrů se shromáždí na cytosolové straně. Dva N-acetyl-glukosaminy a pět zbytků manózy jsou připojeny k fosfátu dolicholu. Jako dárci se objevují cukerné nukleotidy GDP-manóza a UDP-N-acetyl-glukosamin. Prekurzor je transportován přes ER membránu pomocí transportního proteinu.
Prekurzor je tedy orientován směrem dovnitř endoplazmatického retikula, kde jsou do něj přidány čtyři zbytky manózy. Kromě toho se pěstují zbytky glukózy. 14 prekurzor cukru dlouhý je nakonec přenesen na protein. Další formační cestou pro glykoproteiny je O-glykosidická vazba nebo O-glykosylace na serin, k níž dochází v Golgiho aparátu buněk. Cukr je vázán na hydroxylovou skupinu serinu. Hodnoty glykoproteinů jsou zvláště důležité ve vztahu k plazmatickým proteinům, protože hrají roli v kompletním krevním obrazu. Pokud bychom v tomto bodě uvedli všechny normální hodnoty glykoproteinů jednotlivě v tomto bodě, bylo by to nad rámec působnosti.
Nemoci a poruchy
Některá genetická onemocnění mají vliv na glykosylaci. Jednou skupinou takových chorob je CDG. Glykoproteiny vykazují abnormální hodnoty. Postižení trpí zpomaleným vývojem, který souvisí s fyzickými i duševními problémy.
Šilhání může být dalším příznakem genetické poruchy. Na tvorbě glocoproteinů se podílí celkem asi 250 různých genů. V případě vrozených poruch glykosylace jsou poruchy v připojení uhlovodíkových postranních řetězců k proteinům způsobeny genetickou dispozicí. Při posttranslační modifikaci dostávají proteiny plnou funkčnost. V tomto procesu, když jsou enzymy nebo proteiny, které vytvářejí uhlovodíkové postranní řetězce, abnormálně spojeny dohromady, je vytvořen CDG. N-glykosylace je nejčastěji ovlivněna poruchami. K dnešnímu dni bylo objeveno asi 30 enzymových defektů, které mají vliv na N-glykosylaci.
Genetické poruchy O-glykosylace jsou poněkud vzácnější. Projevují se u neuromuskulárních nemocí různých systémů, jako je Walker-Warburgův syndrom. Vzhledem k tomu, že glykoproteiny mají v organismu tolik funkcí, je klinický obraz charakterizován řadou příznaků. Všechny vrozené systémy mohou být ovlivněny vrozenými poruchami glykosylace. Psychomotorické vývojové poruchy jsou hlavním příznakem. Neurologické abnormality jsou stejně běžné. Poruchy koagulace nebo endokrinní poruchy také nejsou neobvyklé.












.jpg)